Giới thiệu
Khí H2S, hay còn gọi là hydro sulfide, là một hợp chất hóa học có những đặc tính hóa học và vật lý đặc biệt. H2S thường được biết đến với mùi trứng thối đặc trưng và khả năng gây độc cho con người. Vậy cụ thể khí H2S Là Gì và nó có những ứng dụng nào trong đời sống? Hãy cùng khám phá trong bài viết dưới đây.
Khí H2S là gì? Cấu trúc của khí H2S
Khí H2S, tên đầy đủ là hydro sulfide, là một hợp chất hóa học bao gồm hai nguyên tử hydro (H) và một nguyên tử lưu huỳnh (S). Công thức hóa học của khí này là H2S.
Cấu trúc của khí H2S
Phân tử H2S có cấu trúc tương tự như phân tử nước (H2O), với lưu huỳnh (S) đóng vai trò là nguyên tử trung tâm liên kết với hai nguyên tử hydro. Tuy nhiên, khác với phân tử nước, H2S không có tính chất phân cực mạnh do lưu huỳnh có độ âm điện thấp hơn so với oxy. Chính vì vậy, lực liên kết giữa các phân tử của H2S yếu hơn, dẫn đến điểm sôi và điểm nóng chảy thấp hơn nhiều so với nước.
Nguồn gốc của khí H2S
Khí H2S thường được hình thành từ quá trình phân hủy các chất hữu cơ bởi vi sinh vật trong môi trường yếm khí (không có oxy). Ngoài ra, khí H2S còn tồn tại tự nhiên trong các hiện tượng như núi lửa, khí tự nhiên, dầu thô và các nguồn nước giếng hoặc suối nước nóng. Điểm thú vị là cơ thể con người cũng sản sinh một lượng nhỏ H2S, đóng vai trò truyền tín hiệu trong các quá trình sinh hóa.
Tính chất lý hóa của khí H2S
Tính chất vật lý
Khí H2S có những đặc điểm vật lý nổi bật sau:
- Mùi đặc trưng: H2S có mùi trứng thối rất dễ nhận biết.
- Trạng thái: H2S là một chất khí không màu, tương đối nặng hơn không khí.
- Các điểm nóng chảy và sôi: Điểm sôi là -60°C và điểm nóng chảy thấp hơn nhiều so với nước.
- Độ hòa tan: Khá dễ hòa tan trong nước và các dung môi hữu cơ.
- Độc tính: H2S là một loại khí độc, có thể gây ra đau đầu hoặc kích ứng ngay cả khi con người hít phải lượng nhỏ.
- Tính dẫn điện: Ở áp suất trên 90 GPa, H2S trở thành chất dẫn điện kim loại.
Tính chất hóa học
Tính chất acid yếu
- H2S là một acid yếu, có khả năng làm đổi màu giấy quỳ tím sang đỏ.
- Phản ứng với dung dịch kiềm:
- H2S + NaOH → NaHS + H2O
- H2S + 2NaOH → Na2S + H2O
- Phản ứng với muối cacbonat:
- H2S + Na2CO3 → NaHCO3 + NaHS
Tính chất khử mạnh
H2S là chất khử mạnh trong các phản ứng hóa học, thường thấy sự tham gia của SH⁻:
- H2S dễ bị oxy hóa khi gặp O₂:
- 2H2S + 3O2 → 2H2O + 2SO2
- H2S có thể phản ứng với kim loại để tạo muối sulfua kim loại:
- 2H2S + 2K → 2KHS + H2
- Khi phản ứng với bạc (Ag), H2S tạo ra muối silver sulfite:
- 4Ag + 2H2S + O2 → 2Ag2S + 2H2O
- Phản ứng oxy hóa H2S với chlorine (Cl₂) trong nước:
- 4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
Phương pháp điều chế khí H2S
Trong phòng thí nghiệm
H2S thường được tạo ra bằng cách phản ứng sắt sulfide với acid mạnh như HCl trong bình Kipp:
- Phản ứng hóa học: FeS + 2 HCl → FeCl2 + H2S
Ngoài ra, có thể áp dụng một số phương pháp khác như:
- Phản ứng giữa sulfide kim loại và nước: 6 H2O + Al2S3 → 3 HS + 2Al(OH)3.
- Phân tích thioacetamide: CH3C(S)NH2 + H2O → CH2C(O)NH2 + H2S.
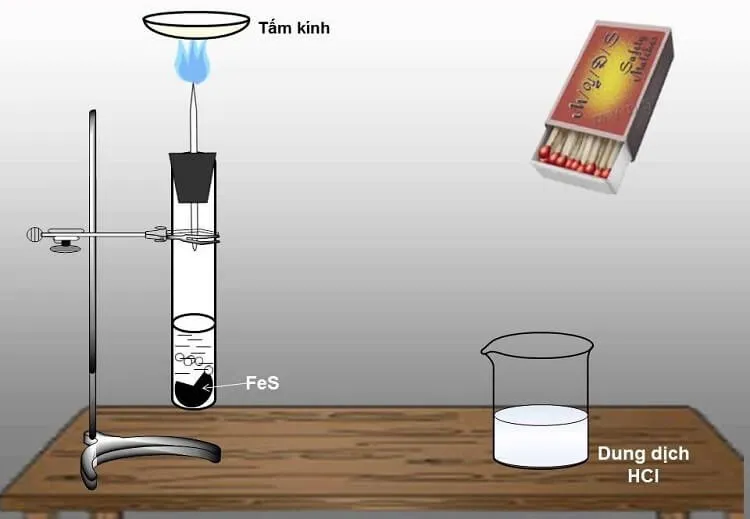 Quá trình điều chế H2S
Quá trình điều chế H2S
Điều chế khí H2S trong môi trường phòng thí nghiệm
Trong công nghiệp
H2S chủ yếu được sản xuất bằng cách tách từ khí chua, tức là các loại khí tự nhiên có hàm lượng H2S cao. Một số phương pháp khác bao gồm:
- Nung nóng lưu huỳnh nguyên tố với hydro ở nhiệt độ khoảng 450°C.
- Vi khuẩn khử sunfat, hoạt động trong môi trường thiếu oxy, có thể sản xuất H2S.
Khí H2S có độc không?
H2S là một chất khí có độc tính và khả năng gây nguy hiểm rất cao, đặc biệt đối với sức khỏe con người:
- Nguy hiểm cháy nổ: Đây là một loại khí cực kỳ dễ cháy, có khả năng gây ra nổ nếu không xử lý cẩn thận. Khi cháy, H2S tạo thành SO₂ có tính độc hại.
- Không khí: Hít phải H2S ở nồng độ thấp có thể dẫn đến các triệu chứng như đau đầu, buồn nôn, khó thở, mệt mỏi hoặc kích ứng mũi, cổ họng và mắt.
- Độc tính nồng độ cao: Hít phải khí H2S ở nồng độ cao (trên 1000 ppm) sẽ ngay lập tức gây ra bất tỉnh, và có thể dẫn đến các tổn thương lâu dài.
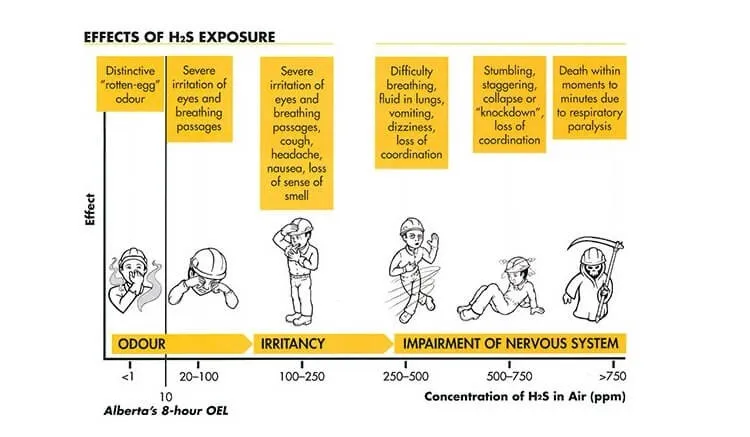 Tác động của khí H2S đến sức khỏe
Tác động của khí H2S đến sức khỏe
Trình bày triệu chứng do nhiễm độc khí H2S
Ứng dụng của khí H2S trong đời sống
Mặc dù nổi tiếng là một loại khí độc, khí H2S vẫn có những ứng dụng thiết thực trong nhiều lĩnh vực:
- Hóa học phân tích: Phân tử H2S thường được sử dụng để phát hiện các ion kim loại trong phân tích hóa học.
- Sản xuất lưu huỳnh nguyên tố: H2S là tiền chất quan trọng trong sản xuất lưu huỳnh nguyên tố và một số hợp chất lưu huỳnh hữu cơ.
- Sản xuất sơn: H2S được ứng dụng để điều chế các loại sulfide kim loại dùng trong ngành sơn.
- Nông nghiệp: Hoạt động khử trùng bằng H2S là một ứng dụng quan trọng trong sản xuất nông nghiệp.
- Y tế: Một lượng nhỏ khí H2S có thể được sử dụng để bảo vệ tế bào thông qua việc ngăn ngừa tổn thương ty thể.
- Gia công kim loại: H2S là thành phần của dầu cắt và chất làm mát, chất bôi trơn trong gia công kim loại.
Kết luận
Khí H2S tuy có độ độc hại cao, nhưng nó vẫn đóng vai trò quan trọng trong nhiều lĩnh vực từ công nghiệp đến y tế và nông nghiệp. Tuy nhiên, việc xử lý khí H2S cần được thực hiện một cách cẩn trọng để tránh nguy cơ gây hại đến sức khỏe và môi trường. Nếu bạn muốn tìm hiểu thêm thông tin về những hợp chất hóa học khác, hãy tham khảo bài viết liên quan về muối sunfat là gì để làm rõ hơn nhiều ứng dụng tuyệt vời của các hợp chất hóa học.
Có thể bạn quan tâm
- NG Viết Tắt của Từ Gì?
- Chinh Phục Game Nổ Hũ Ăn Tiền Hấp Dẫn Cùng ALO789
- Thể Thao Vmax Và Trải Nghiệm Cá Cược Đỉnh Cao Số 1 Việt Nam
- Trải Nghiệm Game Bài God55 Với Không Gian Giải Trí Đẳng Cấp
- Quy tắc trật tự tính từ trong tiếng Anh (OSASCOMP) & Cách ghi nhớ
- Đăng Ký Qq88 Để Mở Ra Thế Giới Cá Cược An Toàn Đẳng Cấp
- Lô Tô Xóc Đĩa Thắng Ngay – Chiến Thuật Nhỏ Nhưng Thắng To
- Nứt Cổ Gà Là Gì? Nguyên Nhân Và Cách Chữa Trị Hiệu Quả
- Dự đoán Lô Đề 23WIN chính xác hôm nay trúng thưởng lớn
- Iwin – Lựa Chọn Tốt Nhất Cho Người Mới Bắt Đầu Cá Cược
